DOMANDE FREQUENTI
Il termine si applica ad ogni tipo di sperimentazione sugli animali, che questi vengano sezionati o no (Enciclopedia Americana)
Operazione su un animale vivo per scopi sperimentali o terapeutici; più in generale, qualsiasi esperimento su animali vivi (Enciclopedia Britannica)
Con significato più estensivo, il concetto di vivisezione può essere applicato a tutte quelle modalità di sperimentazione, non necessariamente cruente, che inducano lesioni o alterazioni anatomiche e funzionali (ed eventualmente la morte) negli animali di laboratorio (Dizionario Treccani)
Quindi il termine vivisezione è sinonimo di sperimentazione animale
Secondo quanto sancito all’art. 15, comma 1 del Decreto Legislativo n. 116/92, il Ministero della salute raccoglie i dati statistici sull’utilizzazione di animali a fini sperimentali in base agli elementi contenuti nelle richieste di autorizzazione, nelle comunicazioni ricevute nonché nelle relazioni presentate ogni anno dai responsabili degli “stabilimenti utilizzatori” autorizzati. Secondo queste statistiche nell’anno 2015, solo in Italia, sono stati utilizzati nelle procedure gli animali riportati in tabella:
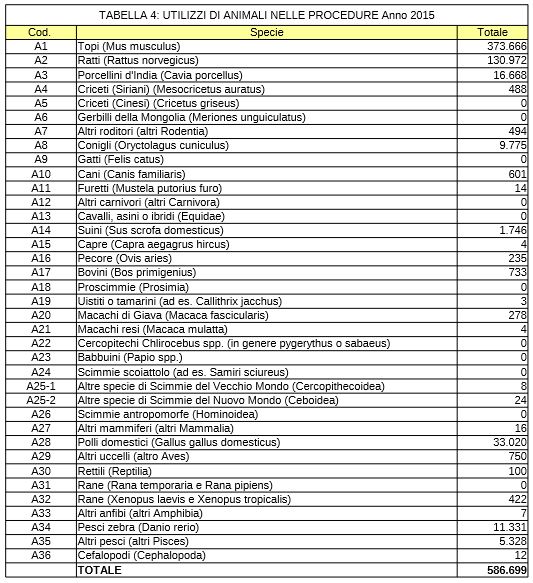
Il numero degli animali utilizzato è comunque sottostimato in quanto queste statistiche non considerano gli animali utilizzati per produrre modelli geneticamente modificati (si tratta di grandi numeri) o per ricavare tessuti o organi per la ricerca.
Secondo il principio delle 3R (Replacement, Reduction, Refinement), per la prima volta introdotto da Russell e Burch nel 1959 nel libro ‘The principles of humane experimental technique’, si chiamano “alternativi” tutti quei metodi che soddisfano le seguenti caratteristiche:
Reduction (Riduzione): Metodi che permettono di ridurre il numero di animali;
Refinement (Raffinamento): Metodi che permettono di ridurre stress e dolore negli animali utilizzati;
Replacement (Sostituzione): Metodi che sostituiscono gli animali con metodologie non animali;
In particolare:
Reduction
La riduzione si riferisce a quei metodi che minimizzano l’uso degli animali e permettono di ottenere lo stesso risultato e le stesse informazioni con un minor numero di animali oppure di ottenere più informazione con lo stesso numero di animali, riducendone perciò il bisogno nella fase successiva.
Esempi di riduzione includono:
– Migliorare i disegni sperimentali e le analisi statistiche
– Condivisione di dati e risorse, comunicazione per evitare di ripetere studi già fatti da altri
Refinement
Si riferisce al miglioramento delle procedure sperimentali o della stabulazione per minimizzare stress, dolore, sofferenza negli animali ancora utilizzati nei laboratori.
Esempi di refinement:
– Utilizzo di tecniche non invasive
– Utilizzo di analgesici per alleviare il dolore
– Alloggiamento idoneo ed opportunamente arricchito (es. opportuni ripari per il nesting dei roditori)
Come accennato, quando si parla di “metodi alternativi”, spesso ci si riferisce a tutte e 3 le R e non soltanto ad absolute replacement.
Replacement
Replacement si riferisce a quei metodi che permettono di sostituire l’animale in un esperimento o un determinato ambito di ricerca. Si parla di “relative replacement” quando una specie animale viene sostituita da un’altra specie caratterizzata da un sistema nervoso relativamente meno complesso di quella originale, oppure quando il protocollo sperimentale prevede comunque il sacrificio dell’animale per l’utilizzo di derivati quali organi, tessuti, ecc. Si parla invece di “absolute replacement” quando il modello animale risulta completamente eliminato dal protocollo sperimentale e viene sostituito totalmente da metodologie non animali. “Absolute replacement” è ciò che la maggior parte delle persone pensa quando si parla di “metodi alternativi”, è il metodo alternativo per eccellenza, il fine ultimo, l’unico che permetterebbe non soltanto di avere dei benefici a livello etico ed economico ma anche e soprattutto a livello scientifico.
Il principio delle 3R è nato nel lontano 1959 esclusivamente per fini etici, per proteggere il benessere animale. All’epoca infatti non esisteva ancora la consapevolezza dei limiti metodologici/scientifici dei test su animali e quasi tutte le tecnologie oggi a disposizione non esistevano. I tempi sono cambiati ma purtroppo i concetti e le definizioni delle 3R sono rimasti quelli di allora. Il termine “alternativi” presuppone che abbiamo dei test che funzionano bene (quelli animali) e che vorremmo sostituirli con altri test (non animali) che funzionano altrettanto bene, per motivi etici. Oggi sappiamo che i test su animali che vorremmo sostituire sono scarsamente affidabili, spesso NON funzionano e raramente sono stati sottoposti a delle vere e proprie procedure di validazione, come richiede oggi ogni metodologia definita scientifica. Ecco perchè sarebbe più corretto parlare di metodologie avanzate per la ricerca, o metodologie human based.
I metodi alternativi alla sperimentazione animale oggi non tanto sono “importanti” quanto scientificamente necessari, indispensabili. I test basati sugli animali si sono infatti rivelati nel tempo di scarsa rilevanza per i pazienti ed incapaci di garantire la sicurezza e la protezione della salute umana.
E’ stata riconosciuta pertanto la necessità di ridimensionare il valore degli animali nella ricerca e di spostare l’attenzione verso metodologie basate sulla biologia umana, che possano gradualmente sostituire l’utilizzo di animali.
Non esiste alcun fondamento scientifico per ritenere che ciò sia vero, come dettagliatamente spiegato da Matthews (2008), nel suo paper “Medical progress depends on animal research. Isn’t it?” in cui l’autore mette a nudo le fallace logiche che si nascondono dietro tali affermazioni.
Invece esistono dati ed evidenze che dovrebbero quanto meno farci sospettare il contrario, ovvero che la ricerca biomedica proceda nonostante la s.a. e non grazie ad essa.
È il processo attraverso cui vengono valutate la rilevanza e l’attendibilità di un test, un approccio o una determinata metodologia, per lo scopo per cui sono stati concepiti.
L’attendibilità è definita in termini di riproducibilità dei risultati entro lo stesso laboratorio e tra diversi laboratori.
La rilevanza di un test si riferisce invece all’utilità ed alla funzionalità del test nello svolgere la propria funzione, nonchè all’identificazione precisa dei suoi limiti.
Ogni metodo definito “scientifico” richiede che se ne conoscano l’attendibilità e la rilevanza.
I test a scopo regolatorio (per valutare ad esempio la tossicità di farmaci e sostanze chimiche) devono essere sottoposti a lunghe e laboriose procedure di validazione portate avanti e valutate da enti indipendenti cui segue l’accettazione da parte degli enti regolatori ed infine il test viene inserito nelle linee guida internazionali (OECD, 2005).
Mentre per i metodi in vitro, almeno quelli utilizzati a scopo regolatorio, esiste una rigorosa politica di validazione, per i metodi in vivo ciò non è previsto: la maggior parte dei test in vivo non ha subito una vera e propria procedura di validazione.
I test su animali vengono generalmente accettati su basi empiriche (come ad esempio la “somiglianza” dei sintomi nell’uomo e nel modello e l’effetto “simile” di farmaci) e per il semplice fatto che si tratta test in vivo e che si è sempre fatto così (pregiudizio).
Ne viene che i test su animali costituiscono un “black box”, una metodologia di cui non si conoscono nè l’attendibilità nè la rilevanza per l’uomo.
Alla luce dell’elevato tasso di fallimento nel tentativo di portare all’uomo i successi riscontrati negli animali e delle più recenti revisioni sistematiche abbiamo tutte le ragioni per dubitare della rilevanza e dell’attendibilità dei test basati sugli animali.
Purtroppo no. Il loro utilizzo è ad oggi a discrezione del laboratorio interessato, che può pertanto decidere di continuare ad utilizzare animali senza incorrere in alcuna sanzione.
Un esempio è il caso del test integrato per la sensibilizzazione cutanea (DPRA + Keratinosens), un metodo alternativo human based validato quale alternativa al Local Lymph Node assay su topo. Nonostante si tratti di una strategia validata e disponibile, si continuano ad applicare i vecchi test. Secondo le statistiche del Ministero della Sanità nel 2013 in Italia sono stati utilizzati oltre 7.200 porcellini d’india e 78 topi per i test di sensibilizzazione cutanea. I motivi risiedono principalmente nei costi (il test su topi è meno costoso) e nel fatto che pochi lo sanno fare, con la conseguente necessità di commissionare il test a terzi, magari alla concorrenza.
Un altro esempio è il test di pirogenicità, per cui esistono diverse alternative in vitro all’utilizzo dei conigli, vengono già utilizzate con successo in molti laboratori ma non in tutti e non in tutti i paesi. Il risultato è che vengono ancora utilizzati migliaia di conigli per testare la presenza di endotossine, quando ciò non solo non sarebbe necessario, ma potrebbe essere fatto attraverso test più rilevanti poichè human based.
Tutti i modelli, che siano in vitro, in silico o in vivo, hanno per definizione dei limiti, proprio perchè si tratta di modelli.
I metodi in vitro e le colture cellulari attualmente utilizzati in fase preclinica, hanno dei limiti ben noti tra i quali, in sintesi: La bidimensionalità; La mancanza di interazione con altri tipi cellulari e con una matrice; L’assenza di stimoli meccanici (flusso, movimento) e biochimici; Se si tratta di linee cellulari, alterazioni del cariotipo, se si tratta di colture primarie, senescenza, numero elevato di passaggi; Possibilità di contaminazioni (es. Mycoplasma, muffe) che possono alterare i risultati degli esperimenti; Impossibilità di studiare gli effetti sistemici (ad es. l’effetto sul cuore di una sostanza somministrata per via orale e metabolizzata dal fegato); Sistemi basati su cellule, tessuti ed organi di specie animali differenti dalla specie target; (per una trattazione completa sui limiti dei metodi in vitro rimandiamo ad Hartung 2007).
Tutto ciò si riassume in una incapacità di riprodurre le condizioni fisiologiche e quindi di predire in modo accettabile le risposte dell’organismo umano, con conseguente scarsa qualità dei test preclinici. Tuttavia la buona notizia è che esiste la possibilità di migliorare notevolmente la rilevanza dei metodi in vitro cambiando l’approccio alle colture cellulari. Si sta passando così sempre di più da semplici colture su una piastra Petri, a co-colture tridimensionali, in bioreattori o sistemi microfluidici, fino a mimare la fisiologia d’organo e a connettere i diversi comparti tra loro in una sorta di sistema multiorgano su chip (body on a chip).
E’ di fondamentale importanza in tale ottica l’utilizzo di cellule, tessuti, organi umani (e quindi di un sistema di raccolta, conservazione, distribuzione del materiale) in luogo di quelli animali e di cellule e tessuti freschi. Anche se le sfide sono molte ed i problemi non mancano, le potenzialità di questi sistemi per la ricerca sono notevoli e i risultati sono molto promettenti. E’ però di fondamentale importanza unire le forze per standardizzare e rendere sempre più accessibili tali metodologie.
Con il sequenziamento dei genomi e l’avvento dell’era post-genomica (anni 2000), le nostre nozioni sui concetti di genetica ed espressione genica si sono evoluti.
Il dogma centrale della biologia molecolare, un principio formulato negli anni cinquanta afferma che in biologia molecolare il flusso dell’informazione genetica è monodirezionale: parte dagli acidi nucleici, per arrivare alle proteine. Un gene, una proteina.
Ma solo di recente sono emersi concetti quali epigenetica, micro-RNA, regolazione genica, network di regolazione genica, sistemi complessi. Oggi sappiamo che non è tanto la sequenza delle basi del DNA a fare la differenza tra un tipo cellulare e l’altro, tra la salute e la malattia, tra individui diversi, bensì lo è la regolazione dell’espressione di tali sequenze, la loro interazione con proteine, micro-RNA ed altre molecole, e ancora l’interazione tra proteine. Ad ogni livello, dalla sequenza di basi sul DNA, fino al prodotto (che può anche non essere una proteina), esistono molteplici punti di regolazione. Pensiamo che fino a pochi anni fa si credeva che tutto il DNA che non codifica per proteine fosse “spazzatura”, mentre oggi sappiamo che ha importantissime funzioni regolatorie.
Che senso ha quindi giustificare, come fanno molti sostenitori dei test in vivo, l’utilizzo del topo come modello di studio per le malattie umane perchè con i topi condividiamo il 90% del DNA? A cosa serve condividere il 90% del DNA se poi l’espressione genica, la regolazione, le proteine, le risposte biologiche sono differenti? Gli scimpanzè condividono con noi oltre il 99% del DNA ma non si ammalano di schizofrenia, AIDS, Alzheimer, sclerosi multipla e tantissime altre patologie che colpiscono l’uomo.
Piccole differenze nella regolazione dell’espressione genica possono portare a grandi differenze nella risposta biologica e fare la differenza tra la salute e la malattia.
Certo. Si tratta di comprendere che la ricerca biomedica non può continuare a far affidamento sui modelli animali come è stato fatto fino ad oggi e che è necessario cambiare direzione, focalizzandosi sempre di più su modelli incentrati sulla biologia umana, sullo studio delle vie metaboliche umane, la mappatura dei percorsi di tossicità, la biologia dei sistemi, ecc. in accordo con la visione proposta dalla tossicologia e la ricerca del XXIesimo secolo.
Si tratta di abbandonare i modelli animali e di intraprendere una strada che va in una direzione diversa da quella dei test in vivo e di dirottare le risorse verso metodi di ricerca innovativi e di farlo in modo concreto.
I metodi alternativi non devono essere visti come un diversivo a complemento della sperimentazione animale, o qualcosa per fare contenti gli animalisti, ma piuttosto come l’unica opportunità per rendere la ricerca più rilevante per i pazienti ed i farmaci più sicuri ed efficaci.
Inoltre, non è ammissibile che laddove esistono già dei metodi alternativi validati, si continui ad utilizzare gli animali e non esista un divieto del loro utilizzo.
In un contesto dove i fondi destinati alle metodologie avanzate human based sono irrisori e perlopiù derivanti da associazioni animaliste, i centri specializzati dedicati allo sviluppo di metodologie avanzate human based sono insufficienti.
La maggior parte dei docenti in discipline biomediche in altrettante università italiane non lavora nel campo dei metodi alternativi, non indirizza gli studenti presso delle strutture che si occupano nello specifico dello sviluppo e diffusione di tali metodi esiste già un sovra-affidamento ai modelli animali se si parla di 3R lo si fa solo in termini etici o economici, ignorando il problema scientifico e l’importanza di una ricerca human based. Spesso chi vorrebbe dedicare i propri studi alle metodologie avanzate si ritrova senza alcun supporto da parte della maggior parte dei docenti e tutors.
Difendere e promuovere la s.a. non ha alcun senso all’interno della comunità scientifica se non quello di frenare ed ostacolare il processo di innovazione che, seppure in fase iniziale, è già in atto e che non può che portare beneficio alla ricerca ed alla salute collettiva.
Per contro, avere un approccio critico alla s.a. e promuovere le metodologie avanzate human based è molto utile per spingere verso il necessario cambiamento.
I principali motivi per cui si tende a non utilizzare i metodi alternativi hanno a che fare con:
- Luoghi comuni
- Ostacoli burocratici
- Pigrizia mentale
- Costi
1. Metodi alternativi? In che senso? Molti addetti ai lavori, quando sentono parlare di test in vitro, di metodi alternativi ed animal replacement, associano il termine al mondo animalista e non immaginano nemmeno che potrebbero essere scientificamente più rilevanti ed affidabili dei test su animali. L’argomento non è familiare alla maggior parte dei ricercatori, che li vedono soltanto come metodi complementari alla sperimentazione animale. Inoltre quasi mai immaginano qualcosa di diverso da una semplice coltura di cellule su una piastra Petri.
2. Il sacrificio degli animali è giustificato per la salute dei miei figli. L’opinione generale è che i risultati della sperimentazione animale siano quasi sempre affidabili e che i test sugli animali diano informazioni precise e sicure sull’ efficacia dei farmaci o sulla tossicità. La maggior parte delle persone non pensa che i test animali potrebbero dare un’alta percentuale di falsi negativi o falsi positivi. a convinzione che il sacrificio degli animali salvi delle vite umane mette a posto la coscienza da qualsiasi considerazione etica circa l’uso degli animali nei laboratori.
3. I test su animali sono obbligatori, ecco tutto. Alcuni produttori e utilizzatori a valle sono convinti che le sostanze chimiche non siano affatto pericolose. La valutazione della loro tossicità è un peso burocratico che il legislatore impone loro per rendergli la vita difficile. Questa categoria di persone non può essere convinta in alcun modo che è possibile perseguire una strategia scientifica più affidabile ed efficace per una valutazione più precisa della sostanza chimica. A loro importa solo di avere tutti i documenti in ordine nel caso capitasse un controllo.
4. Un end point = un test in vivo. L’atteggiamento di cui sopra viene rinforzato da due fattori egualmente importanti. Primo, la certezza che i test con gli animali verranno accettati senza battere ciglio dagli enti regolatori. Secondo, il convincimento derivante da una certa pigrizia mentale per cui i test in vivo sono molto più semplici da organizzare e da seguire, e che da loro sia anche più semplice estrapolare i risultati. La corrispondente casella del dossier REACH viene spuntata in un attimo quando arriva il rapporto dal laboratorio. Non c’è nient’altro da fare. Può darsi che questo approccio sia più caro, ma è anche molto più semplice. Invece, le strategie integrate (ITS) devono essere studiate e valutate. Richiedono più tempo e più impegno specializzato. Comportano la valutazione di relazioni provenienti da laboratori diversi e magari presentate con modalità diverse. I risultati devono essere confrontati e analizzati con cura per arrivare a una conclusione. E’ importante sottolineare che proprio per questo motivo la conoscenza che si acquisisce su una determinata sostanza risulta col tempo sempre più precisa ma questo aspetto non interessa al dichiarante. Dal suo punto di vista oltre a salvare molte vite animali, una ITS azzeccata ha l’unico vantaggio di essere meno cara. Ma è un vantaggio più che controbilanciato dall’iter più lungo e complicato e dalla possibilità che i risultati finali vengano rifiutati dagli enti regolatori.
5. Ho sempre utilizzato quel test. Sostituire una procedura che viene eseguita di routine da decenni è molto difficile. Le persone sono state addestrate in quel modo e si sentono molto più a loro agio a continuare nel solco tracciato. Di fatto non hanno grandi motivi per cambiare, ai loro occhi i vantaggi insiti nei metodi alternativi sono trascurabili o del tutto inesistenti.
6. Il tempo è denaro. La crisi con cui devono fare i conti tutte le industrie del settore è una realtà importante. La produzione di alcune aziende è crollata dell’80% nel corso del 2009. E’ facile capire che molti importatori e produttori si concentrino su questa penosa perdita di entrate piuttosto che sulle strategie migliori per l’animal replacement. Molto spesso si lavora sotto pressione: bisogna pubblicare un dossier, un paper o completare un report e bisogna farlo in fretta. Aumentare l’uso dei metodi alternativi viene consigliato per legge ma non è obbligatorio e nessuno ha voglia di sprecare tempo in cose che non reputa essenziali.
7. Mancanza di competenze. Pochi addetti ai lavori sono consapevoli dei benefici che derivano da una adeguata strategia integrata (ITS). I metodi alternativi richiedono personale addestrato, impegno a tempo pieno e lavoro di squadra. Idealmente richiedono dei centri specializzati, molto attivi nello sviluppo e nella divulgazione della conoscenza di tali metodologie. Raramente esiste questo tipo di approccio. In Italia sono rari i casi in cui presso le università sono istituiti dei corsi appositi per formare studenti ed addetti ai lavori. Difficilmente gli studenti vengono stimolati ad intraprendere degli studi che riguardino le metodologie avanzate human based e l’animal replacement. Spesso i metodi alternativi vengono del tutto ignorati.
8. I risultati negativi dei test in vitro non vengono accettati per legge. L’Allegato XI del REACH (acronimo di “Registration, Evaluation, Authorisation and restriction of CHemicals” che prevede la registrazione di tutte le sostanze prodotte o importate nell’Unione europea in quantità maggiori di una tonnellata per anno), accetta i risultati dei test in vitro non ancora convalidati solo quando essi risultano positivi, vale a dire quando la sostanza esaminata è tossicologicamte attiva e comporta dei rischi tossicologici. Viceversa, se i risultati sono negativi, se cioè la sostanza non risulta attiva a livello tossicologico, essi devono essere confermati da nuovi test su animali. Di fatto la maggior parte delle sostanze chimiche non è pericolosa e di conseguenza la probabilità di ottenere un risultato negativo è molto alta. A quale scopo quindi impegnare tempo, denaro ed energie nello sviluppo ed applicazione di metodi per l’animal replacement, con il rischio che poi questo non serva comunque a nulla?
9. I risultati positivi dei test in vitro non vengono accettati dalle imprese. La generale mancanza di conoscenza circa le proprietà delle sostanze chimiche comporta che la maggioranza di esse non siano classificate come pericolose e quindi non siano elencate nell’allegato VI del Regolamento CLP (acronimo per Classification, labeling and packaging � Classificazione, etichettatura e imballaggio, Regolamento EC 1272/2008). Per alcune sostanze l’esecuzione dei nuovi test porterà con ogni probabilità ad una nuova classificazione. Per i produttori e gli utilizzatori a valle questo comporterà la necessità di nuove misure di sicurezza o peggio una serie di restrizioni nell’utilizzo della sostanza. E’ chiaro quindi che nessun risultato positivo verrà facilmente accettato e che ogni qualvolta la sostanza risulterà tossica nei test in vitro, nuovi test su animali verranno effettuati nella speranza di un risultato negativo.
10. Le riviste scientifiche tendono a non dare peso ai risultati di uno studio se mancano i test in vivo. Questo è un grave; problema, soprattutto nei casi in cui i risultati sono già noti da esperienza sui pazienti, studi epidemiologici, ecc. ma viene richiesta la conferma sperimentale negli animali. I ricercatori sono così costretti a scegliere la specie, il ceppo e le condizioni sperimentali adeguate per poter dimostrare qualcosa che è già noto. Esempio i ripetuti tentativi di indurre tumori ai polmoni negli animali esposti al fumo di sigaretta, indurre nei roditori le malformazioni agli arti causate dal talidomide.
11. Costi elevati. Non è sempre vero che i metodi in vitro costano meno dei test sugli animali. Ad esempio il test tradizionale di sensibilizzazione cutanea che impiega porcellini d’india ha un costo meno elevato del Local Lymph Node Assay, a sua volta meno costoso del metodo alternativo per eccellenza, quello basato su batterie di test incentrati sulla biologia umana.
Non è sempre vero e non si può generalizzare. Anche se in linea di massima ciò è sicuramente vero nel lungo termine e per sostituire quei test che richiedono molti anni e molti animali, non si può dire lo stesso per quei test alternativi complessi, che richiedono un approccio integrato, strumentazioni costose e personale addestrato. Inoltre le colture cellulari per poter essere un metodo valido ed affidabile richiedono la conoscenza delle buone pratiche e tutta una serie di accorgimenti, sistemi e mezzi di coltura che attualmente non sono nè economici nè scontati.
Tratte dal sito “oltrelasperimentazioneanimale.eu”
